پیوندهای شیمیایی و انواع آن
به نیرویی که سبب میشود تا یونها و مولکولها کنار یکدیگر نگه داشته شوند، پیوند شیمیایی گفته میشود. پیوندهای شیمیایی که ناشی از ترکیب شدن اتمها هستند درواقع از تغییر آرایش الکترونی حاصل میشوند.
انواع پیوندهای شیمیایی
1. پیوند فلزی
این پیوندها در فلزات و آلیاژها دیده میشود. اتمها در ساختاری سهبعدی قرار دارند و الکترونهای لایهای بیرونی این اتمها آزادانه در سراسر این ساختار حرکت میکنند و وظیفه به هم نگهداشتن لایه مزبور را به عهده دارد.
ساختار سهبعدی پیوندهای فلزی را به مانند ظرفی مملو از چسب در نظر بگیرید که گویهایی در آن جای گرفتهاند. با ذرات چسب مایع که به هم پیوسته و در سراسر ظرف پراکندهاند به منزله الکترونهای آزاد و گویها در نقش اتم میباشد.
توجیه خواص فلزات با پیوند فلزی
رسانایی الکتریکی
جریان الکتریکی درواقع جریان الکترونهاست، زمانی که دو سر سیم برق را به یک تکه فلز متصل میکنیم تعداد زیادی الکترون به سمت قطب مثبت جاری میشوند و به وسیلهی سیم از فلز خارج میشوند، این اتفاق باعث کمبود الکترون در فلز میشود و الکترونهای غیر مستقر قسمتهای دیگر فلز را به سمت خود میکشد و الکترونهای از دست رفته به وسیلهی جریانی از الکترونها جبران میشود، با تکرار این روند جریان الکتریکی ایجاد میشود.
رسانایی گرمایی
دما جنبش الکترونهای غیر مستقر را افزایش داده و به دلیل پیوستگی این الکترونها، دما به تمام قسمتهای فلز منتقل میشود. درخشندگی و جلای فلزات: تابش نور به الکترونهای غیر مستقر به آسانی باعث برانگیخته شدن آنها میشود و بازگشت آنها به حالت پایه باعث تابش نور مرئی میشود، بعضی فلزات به این خاطر رنگی متمایز دارند که الکترونهایشان حالتهای ایستادهی متفاوتی نسبت به بقیهی فلزات دارند.
پدیدهی فوتوالکتریک
انرژی دادن به الکترونهای غیر مستقر (به صورت گرمایی یا تابشی) ممکن است به حدی آنها را برانگیخته کند که آنها را از فلز جدا کرده و در صورت نیاز میتوان این الکترونها را در مداری به جریان درآورده و جریان الکتریکی تولید کنیم. چکشخواری: وقتی ضربهای به فلز وارد میشود یونهای مثبت فلزی در دریای الکترون منفی جابجا میشوند اما این دریای الکترون با حفظ پیوستگی یونهای مثبت فلزی جلوی شکستگی فلز را میگیرند.
تعاریف کاربری
شعاع اتمی: در هر اتم به فاصلهی هسته تا حد نهایی حضور الکترون شعاع اتم گفته میشود.
شعاع واندروالسی: به نصف فاصلهی هستههای دو اتم در بلور یک فلز و یا نصف فاصلهی هستهی اتمهای مجاور در مولکولهای دو اتمی شعاع واندروالسی گفته میشود.(عکس)
شعاع کوالانسی: نصف فاصلهی هستهها در پیوند کوالانسی مولکولهای دو اتمی را شعاع کوالانسی میگویند.
2. پیوند یونی
پیوندی که بین ذرات مثبت و منفی تشکیل میشود از شرایط لازم برای انتقال الکترون از اتمی به اتم دیگر و شکلگیری این پیوند این است که یک اتم فلز و راغب به از دست دادن الکترون باشد و دیگری نافلز و مادهی گرفتن الکترون که البته شرایط دمایی نیز مؤثر است.
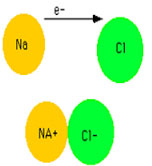
اتمهایی که الکترون به دست میآورند و بار منفی دارند آنیون و اتمهایی که الکترون از دست داده و بار مثبت پیدا میکنند کاتیون نام دارند.
پیوند يونی ممکن است بین فلزات و نافلزات باهم (مانند MgO كه متشكل از یونهای منیزیم و اکسید است)، بین نافلزات باهم (مانند PCl5 که در حالت جامد متشکل از کاتیونی های PCl4 یک مثبت و آنیونهای PCl6 یک منفی است) و بین فلزات باهم (مانند CsAu که متشکل از یونهای Cs یک مثبت و Au یک منفی است) مشاهده شود. پیوند يوني معمولاً بین فلزات و نافلزات باهم مشاهده میشود. اين مطلب میتواند به سهولت کنده شدن الکترون از فلزات و تمایل بالای نافلزات برای گرفتن الكترون و در نتیجه سهولت ایجاد یونها در ترکیبات فلزات و نافلزات باهم نسبت داده شود. به عنوان مثال در مواد KF, Al2O3, FeCl2, Na2SO4, BaCO3 و ... که متشكل از فلزات و نافلزات هستند، ما پیوند یونی داریم.
نامگذاری ترکیبات حاوی پیوند یونی
برخی از آنیونها چند اتمی هستند. این آنیونها معمولاً آنیونهای اکسیژندار هستند. برخی از این آنیونها فقط در تعداد اتمهای اکسیژن تفاوت دارند. اگر دو آنیون تحت این شرایط داشته باشیم، نام آنیون با تعداد اكسیژن بیشتر، نام غیر فلز با پسوند «ات» است و نام آنیون با تعداد اكسیژن کمتر نام غیر فلز با پسوند «یت» است. در صورتی که تعداد آنیونها بیشتر باشد، از پیشوند های هیپو و پر در ترکیب با پسوندهای «-يت» و «-ات» استفاده میکنیم. پر برای ترکیب با بیشترین تعداد اكسیژن در ترکیب با پسوند «-ات» و هیپو برای ترکیب با كمترين تعداد اکسیژن در ترکیب با پسوند «-يت» به کار میرود.
در مورد ترکیبهای شامل یونهای تک اتمی، نام كاتيون همان نام فلز است و نام آنیون از ریشه انگلیسی نام غیر فلز گرفتهشده و پسوند «-ید» به انتهای آن اضافه میشود.
بیشتر فلزات واسطه و برخی از فلزات اصلی میتوانند کاتیون های با بارهای مختلف ایجاد نمایند. در این صورت طبق قواعد نامگذاری آی و پاک، بار هر كاتيون به صورت عدد رومی داخل پرانتز در جلوی نام فلز ذکر میشود.
بهعنوانمثال CuSO4.5H2O مس (II) سولفات پنتا هيدرات نامیده میشود.
3. پیوند کوالانسی
پیوندی است که با اشتراک گذاشتن الکترونهای لایه ظرفیت اتمها و رسیدن به آرایش پایدار گاز نجیب تشکیل میشود. به پیوند کوالانسی اغلب پیوندهای مولکولی گفته میشود که مهمترین شرط تشکیل آن وجود اوربیتال تک الکترونی با اسپین مخالف در لایهی ظرفیت است. پیوند کوالانسی بین دو اتم نافلز و یا یک فلز و یک اتم نافلز با اختلاف الکترونگاتیوی کم تشکیل میشود
- الکترونگاتیوی: تمایل نسبی هسته اتمها برای جذب الکترونهای پیوندی به سمت هسته خود است.
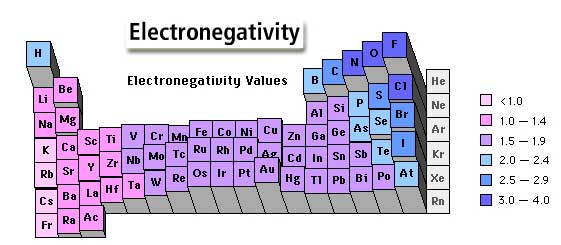
- پیوند کوالانسی نا قطبی: پیوندی است که در آن الکترونهای پیوندی به طور یکنواخت بین دو اتم توزیعشده و هیچیک از اتمها بار الکتریکی جزئی مثبت یا منفی ندارند مانند پیوند در مولکول H2
- پیوند کوالانسی قطبی: پیوندی است که در آن الکترونهای پیوندی به طور یکنواخت بین دواتم توزیع نمیشوند. بنابراین اتم الکترونگاتیو تر بار جزئی منفی و اتم دیگر بار جزئی مثبت خواهد داشت مانند پیوند در مولکول HCL
4. پیوندها با نیروی واندروالسی
به طور کلی نیروی جاذبهای که در مولکولهای قطبی، قطبی قطبی، نا قطبی نا قطبی، نا قطبی وجود دارد نیروی واندروالسی میباشد.
عوامل مؤثر بر نیروی واندروالسی
- قطبیت مولکول: هرچه مولکول قطبی تر باشد نیروی واندروالسی بین مولکولها بیشتر است.
- اندازه مولکول: هرچه مولکول بزرگتر باشد به عبارت دیگر درجه اول حجم و سپس جرم بیشتری داشته باشد نیروی واندروالس بیشتر خواهد بود.
5. پیوندهای هیدروژنی
هرگاه اتم هیدروژن در یک ترکیب شیمیایی به یکی از عناصر الکترونگاتیو با شعاع کوچک مانند نیتروژن، اکسیژن و فلوئور متصل باشد، دارای مقدار زیادی بار مثبت میشود که میتواند با همین اتمها در مولکولهای دیگر جاذبهای برقرار کند و نوعی نیروی بین مولکولی ایجاد نماید که به دلیل قدرت زیاد این نیرو به آن پیوند هیدروژنی میگویند.
معمولا این پیوند را با نقطهچین نمایش میدهند.
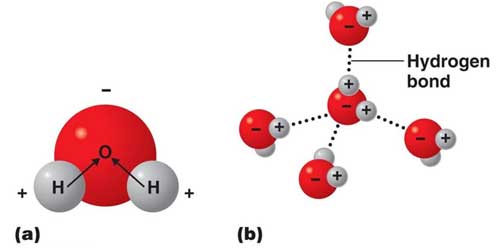
پیوند هیدروژنی را نمیتوان پیوند یونی یا کوالانسی در نظر گرفت زیرا انتقال یا اشتراک الکترون صورت نمیپذیرد، فقط جاذبهی بارهای نا همنام بین مولکولهاست که خواصی از قبیل افزایش دمای جوش را ایجاد میکند.
پیوند هیدروژنی یکی از عوامل مؤثر در توجیه استعداد آب در مقادیر زیاد گرما، کشش سطحی رفتار انبساطی به هنگام انجماد و ... میباشد.
6. پیوند داتیو
نوعی پیوند کوالانسی است که دران جفت الکترون پیوندی توسط یکی از اتمها به اشتراک گذاشتهشده و اتم دیگر جفت الکترون را میپذیرد.
پیوند داتیو در نحوهی تشکیل با پیوند کوالانسی معمولی تفاوت دارد.
پیوند موجود در مولکول از نوع داتیو است.
شرط تشکیل پیوند داتیو: پیوند داتیو در حالتی تشکیل میشود که یک اتم (در مولکولها به عنوان اتم مرکزی) دارای حداقل یک جفت الکترون ناپیوندی در لایه بیرونی خود بوده و اتمی دیگر (در مولکولها به عنوان اتم مرکزی) حداقل یک اوربیتال خالی در لایه بیرونی خود داشته باشد.
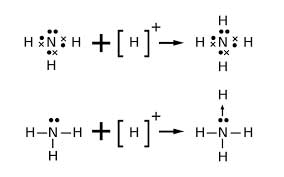
گردآورنده: مهندس محمد بهجتی
منبع: جزوه کیفیت آب و فاضلاب- دکتر قارداشی
شرکت زادآب به عنوان تولیدکننده تجهیزات آب و فاضلاب آماده ارائه مشاوره رایگان به شما عزیزان می باشد. در صورت نیاز به مشاوره با کارشناسان ما تماس حاصل فرمایید.
021-55256411-12
09223345280
